蛋白質(zhì)生物學(xué)概述(一)
生物分子的強、弱相互作用及種類
? 從生物分子內(nèi)到分子間、從強到弱的作用力依次為:離子鍵(ion-ion)、共價鍵(covalent bonds)、配位鍵/配價鍵(coordination bonds);離子偶極(ion-dipole)、london dispersion(倫敦色散)、氫鍵(H-bonding)、偶極偶極力(dipole-dipole)、色散力(dispersion)。如下圖:
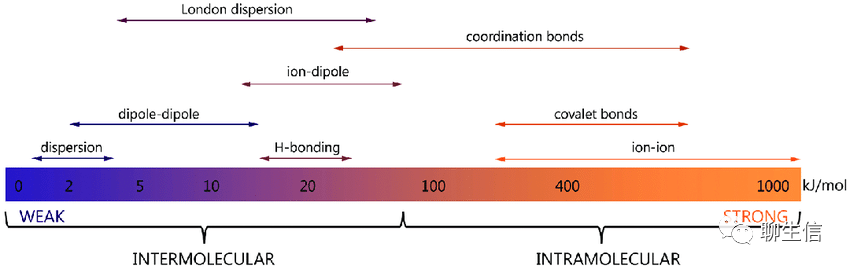
DOI:10.1002/advs.201900506
https://www.slideserve.com/medea/properties-of-water
部分與蛋白質(zhì)有關(guān)的作用力:
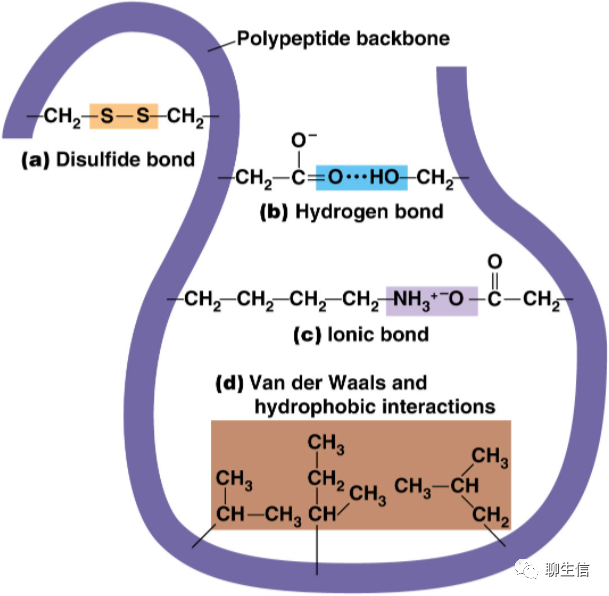
離子鍵(ion-ion):也稱為鹽鍵,由兩個或多個原子或化學(xué)基團失去或獲得電子而成為離子后形成,即帶負(fù)電和帶正電的原子或基團之間產(chǎn)生的靜電吸引力。
共價鍵(covalent bonds):兩個或多個 原子 共同使用它們的外層電子,在理想情況下達到電子飽和的狀態(tài),由此組成比較穩(wěn)定的化學(xué)結(jié)構(gòu)。其本質(zhì)是 原子軌道重疊后,高概率地出現(xiàn)在兩個原子核之間的電子與兩個原子核之間的電性作用。
配位鍵/配價鍵(coordination bonds):常以一個由給電子的原子指向受電子的原子的箭頭表示之。例如存在于配位化合物分子中的配價鍵。
離子偶極(ion-dipole)和偶極偶極力(dipole-dipole):分子-分子,或分子-離子之間的作用力(定向力、誘導(dǎo)力、色散力),以及由此而產(chǎn)生的沒有方向性和飽和性的作用力,也叫非專屬作用力,包括:離子偶極力,偶極偶極力、偶極誘導(dǎo)偶極力,瞬時偶極誘導(dǎo)偶極力。常用極性來概括表示這些作用力,屬于分子間力(廣義)。庫侖力即靜電吸引力,它包括離子離子力和離子偶極力。電荷分布不對稱的電中性分子具有永久偶極矩μ。對于這種偶極分子,如果用q表示電量相等的兩個相反電荷,而用d表示它們分開的距離,則偶極矩μ=qd。當(dāng)將這種偶極置于某種離子所產(chǎn)生的電場中時,偶極本身會發(fā)生定向,吸引端(此端的電荷與離子電荷相反)將向著離子,而排斥端將背著離子。
倫敦色散力 (London Dispersion Force)和色散力(dispersion):是范德華作用力(Van Der Waal Force)的一種,廣泛存在于所有分子之間。這起因于分子內(nèi)電子和原子核的不斷運動(分子的變形性),產(chǎn)生分子的瞬間偶極矩 ,并在鄰近分子中誘導(dǎo)一個偶極矩,它們之間的相互作用產(chǎn)生凈吸引力。
氫鍵(Hydrogen Bond):氫原子與電負(fù)性大的原子X以共價鍵結(jié)合,若與電負(fù)性大、半徑小的原子Y(O、F、N等)接近,在X與Y之間以氫為媒介,生成X-H…Y形式的一種特殊的分子間或分子內(nèi)相互作用。X與Y可以是同一種類分子,如水分子之間的氫鍵;也可以是不同種類分子,如一水合氨分子(NH3·H2O)之間的氫鍵。
疏水作用(hydrophobic interaction):疏水作用力,不屬于化學(xué)鍵,而是多肽鏈上的某些氨基酸的疏水基團或疏水側(cè)鏈(非極性側(cè)鏈),由于避開水而造成相互接近、粘附聚集在一起,在維持蛋白質(zhì)三級結(jié)構(gòu)方面占有突出地位。
下文關(guān)于蛋白質(zhì)生物學(xué)的內(nèi)容主要來自《Molecular Biology of the Cell》的第四版 ("Protein Function"章節(jié))。
我們已經(jīng)知道,每種類型的蛋白質(zhì)都由一個精確或確定的氨基酸序列組成,使其能夠折疊成特定的三維形狀或構(gòu)象,擁有設(shè)計精良的運動部件(moving parts),且可將機械動作(mechanical actions)與化學(xué)事件相耦合。這些特性賦予了蛋白質(zhì)非凡的能力,成為活細(xì)胞動態(tài)(生物)過程的基礎(chǔ)。
所有的蛋白都能與其它分子結(jié)合
因此,“binding”是蛋白質(zhì)的第一大特性。被結(jié)合的無論是離子、小分子還是大分子,都被稱為該蛋白質(zhì)的配體(來源于拉丁語ligare,意思是“to bind”)。
蛋白質(zhì)選擇性結(jié)合并與配體具有高親和力的能力取決于:一組弱的、非共價鍵,例如氫鍵、離子鍵和范德華力,以及有利的疏水相互作用的形成。因為每個單鍵都是弱鍵,有效的結(jié)合作用需要同時形成許多弱鍵。
只有當(dāng)配體分子的表面輪廓與蛋白質(zhì)非常接近,就像手套里的手一樣匹配,這才有可能實現(xiàn),這是蛋白質(zhì)與第二分子(配體)結(jié)合的一個原則,促使蛋白質(zhì)和配體之間形成大量的非共價鍵。
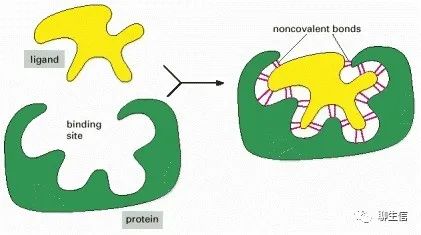
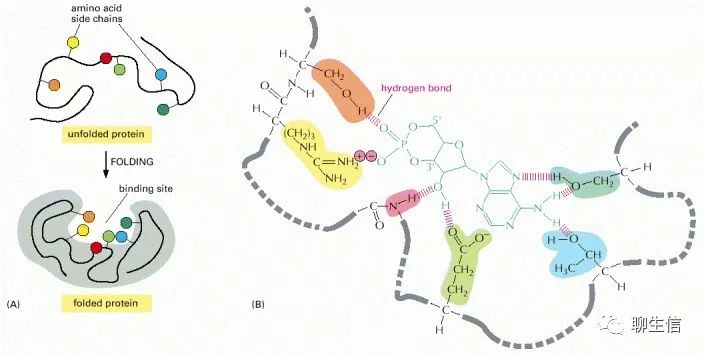
(A)多肽鏈的折疊通常會在蛋白質(zhì)表面產(chǎn)生縫隙或空腔。這個縫隙中含有一組氨基酸側(cè)鏈,它們只能與某些配體形成非共價鍵。(B)一個實際結(jié)合位點的特寫,顯示了蛋白質(zhì)和它的配體之間形成的氫鍵和離子相互作用,在這個例子中cAMP(cyclic AMP)是結(jié)合的配體。
雖然隱藏在蛋白質(zhì)內(nèi)部的原子與配體沒有直接接觸,但它們提供了一個基本的支架,使蛋白質(zhì)表面具有特定輪廓和化學(xué)性質(zhì)。即使是蛋白質(zhì)分子內(nèi)部氨基酸的微小變化也能改變其三維形狀,足以破壞其表面的結(jié)合位點。
蛋白質(zhì)構(gòu)象的細(xì)節(jié)決定了它的化學(xué)性質(zhì)
蛋白表面相鄰的化學(xué)基團通常以增強氨基酸側(cè)鏈的化學(xué)反應(yīng)性的方式進行相互作用:
排除水分子。水分子之間傾向于形成氫鍵,也可以與配體競爭蛋白質(zhì)表面的位置,如果排除水分子,蛋白質(zhì)及其配體之間的氫鍵(和離子間的相互作用)的緊密性將大大增加;
相鄰、相同極性氨基酸在側(cè)鏈的聚集。如果一些帶負(fù)電荷的側(cè)鏈通過蛋白質(zhì)折疊的方式,在相互排斥的情況下被迫聚集在一起,那么它們對一個帶正電荷的離子的位點親和力就會大大增加。此外,當(dāng)氨基酸側(cè)鏈通過氫鍵相互作用時,通常不反應(yīng)的側(cè)基(如下圖中絲氨酸上的CH2OH)可以發(fā)生反應(yīng),使它們能夠進入“產(chǎn)生或破壞其它分子共價鍵”的反應(yīng)。
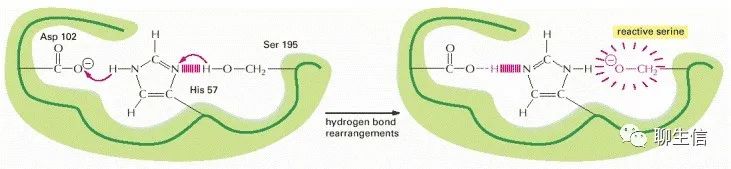
因此,每個蛋白質(zhì)分子的表面都具有獨特的化學(xué)反應(yīng)性,這不僅取決于哪些氨基酸側(cè)鏈暴露在外,還取決于它們彼此之間的確切方向。因此,即使是同一蛋白質(zhì)分子的兩種稍有不同的構(gòu)象,其化學(xué)性質(zhì)也可能有很大的不同。
蛋白家族內(nèi)的序列比較可發(fā)現(xiàn)配體結(jié)合的關(guān)鍵位點
因此,可以利用進化追蹤(“evolutionary tracing”)的方法來確定蛋白質(zhì)結(jié)構(gòu)域中對結(jié)構(gòu)域功能最重要的部位。為此,可將所有已知蛋白質(zhì)家族成員中未改變或幾乎未改變的氨基酸映射到某個家族成員的三維結(jié)構(gòu)模型上,最固定(invariant)(可能最重要)的位置通常會在蛋白質(zhì)表面形成一個或多個簇,如下圖。這些簇通常是與配體結(jié)合的關(guān)鍵位點。
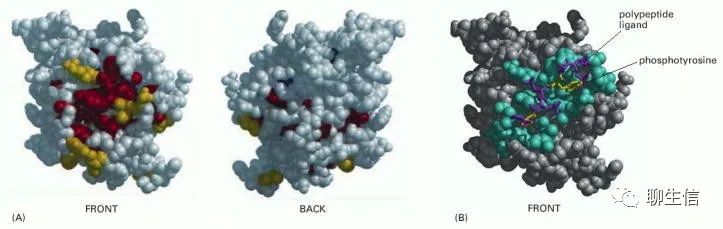
(A) SH2結(jié)構(gòu)域空間填充模型的正面和背面視圖,蛋白質(zhì)表面進化保守的氨基酸為黃色,更靠近蛋白質(zhì)內(nèi)部的氨基酸為紅色。(B) SH2結(jié)構(gòu)域及其結(jié)合多肽的結(jié)構(gòu)。在這里,那些位于結(jié)合配體0.4 nm范圍內(nèi)的氨基酸顯示為藍色。配體的兩個關(guān)鍵氨基酸是黃色的,其他的是紫色的。
蛋白與蛋白互作時的幾種接口類型
兩種蛋白質(zhì)相互結(jié)合的三種方式:
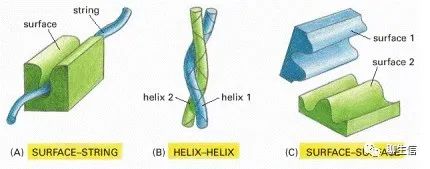
(A)一種蛋白質(zhì)的剛性表面(rigid surface)可以與第二種蛋白質(zhì)的多肽鏈的延伸環(huán)(a “string”:extended loop of polypeptide chain)結(jié)合。(B)兩個α螺旋可以結(jié)合在一起形成一個線圈。(C)兩個互補的剛性表面(Surface-Surface)經(jīng)常將兩個蛋白質(zhì)結(jié)合在一起。
1. 表面-串(surface–string interaction)相互作用。一個蛋白質(zhì)表面的一部分與另一個蛋白質(zhì)上的多肽鏈的延伸環(huán)相接觸。例如這種表面-串的相互作用,使SH2結(jié)構(gòu)域能夠識別磷酸化的多肽,就像剛才描述的那樣,它也使蛋白激酶能夠識別它將要磷酸化的蛋白質(zhì)。具有定位、識別與引導(dǎo)等功能。
2. 兩個α螺旋形成卷曲螺旋(coiled-coil),存在于一些基因調(diào)節(jié)蛋白家族中。
3.?通過一個剛性表面與另一個剛性表面的精確匹配,是蛋白質(zhì)相互作用最常見的方式。這種相互作用可能非常緊密,因為在兩個匹配良好的表面之間會形成大量的弱鍵。出于同樣的原因,這種表面-表面的相互作用可以是非常特異的,使蛋白質(zhì)可以從細(xì)胞中發(fā)現(xiàn)的數(shù)千種不同的蛋白質(zhì)中,準(zhǔn)確選擇一個伙伴或伴侶。
抗體的結(jié)合位點尤其多變
抗體或免疫球蛋白是免疫系統(tǒng)對外來分子(如入侵微生物表面的分子)作出反應(yīng)而產(chǎn)生的蛋白質(zhì)。每個抗體都與特定的目標(biāo)分子緊密結(jié)合,因此要么直接使目標(biāo)失活,要么將其標(biāo)記為(可以)摧毀。抗體以顯著的特異性識別它的靶靶標(biāo)(抗原)。因為我們可能會遇到數(shù)十億種不同的抗原,所以我們必須能夠產(chǎn)生數(shù)十億種不同的抗體(聊生信:但我們并不需要擁有數(shù)十億種基因,這正是免疫學(xué)迷人的地方之一)。
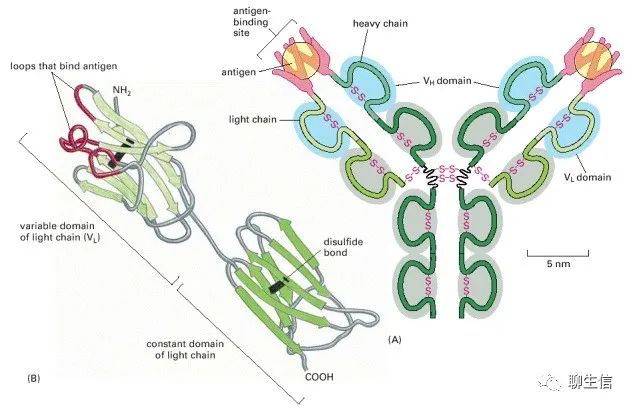
(A)由四個多肽鏈由二硫鍵連接在一起,含幾個不同的免疫球蛋白結(jié)構(gòu)域組成,用藍色或灰色表示。抗原結(jié)合位點是在重鏈可變域(VH)和輕鏈可變域(VL)靠近的地方形成的。(B)輕鏈的帶狀模型顯示了與抗原結(jié)合最密切的VL結(jié)構(gòu)域部分,呈紅色,貢獻了(A)中每個抗原分子周圍的指狀環(huán)的一半。
這種環(huán)(loops)非常適合捕捉其他分子。它們允許大量的化學(xué)基團包圍配體,這樣蛋白質(zhì)就可以用許多弱鍵與配體相連。由于這個原因,環(huán)常被用來形成蛋白質(zhì)中的配體結(jié)合位點(loops are often used to form the ligand-binding sites in proteins)。
